2025-03-27 12:22:30
2015年发布《关于药品**器械审评审批制度的意见》,提出药监五大目标,将eCTD纳入**药监数字化战略。2017年,中国加入ICH(国际人用药品注册技术协调会),成为全球第八个监管机构成员,加速与国际标准接轨。2018年,**药监局(NMPA)完成eCTD文档管理系统招标,由上海宝信与德国LORENZ合作搭建技术平台,标志着技术基础设施的落地。 ?规范制定与试点阶段(2019-2023年)? 2019-2020年,CDE(药品审评中心)发布《eCTD技术规范》《验证标准》等征求意见稿,并组织两轮广发·体育测试。2021年,NMPA明确化学药1类、5.1类及生物制品1类上市申请适用eCTD。2022年实施电子申报(非eCTD格式),2023年取消纸质资料提交,为eCTD铺开奠定基础。 ?实施与扩展阶段(2024-2025年)? 2024年3月更电子申报技术要求,7月启动网络传输试点。2025年1月27日,NMPA将eCTD适用范围扩大至化药1-5类临床试验及上市申请、生物制品1-3类全流程,覆盖药、仿制药及生物类似药,实现与国际主流申报模式同步。欧盟IND注册申报相关技术支持。中国澳门国产eCTD

eCTD提交流程与ESG系统:FDA要求通过电子提交网关(ESG)传输eCTD文件,单个文件大小限制为10GB,超限需拆分或通过物理介质(如光盘)递交。提交前需预分配申请号(如NDA编号),并通过ESG测试账户验证技术合规性。序列号命名规则为4位数字(如0001),申请需从“原申请”序列开始,补充资料按递增顺序编号。广发·体育可自愿提交预审样本(Pre-Submission),FDA将反馈文档结构、元数据等合规性问题。验证标准与常见错误类型:FDA验证标准分为高(High)、中(Medium)、低(Low)三级,高风险错误(如无效XML或缺失关键表格)必须修复,否则直接拒收。常见问题包括:重复序列号(错误1034)、文件路径超长(警告2015)、PDF加密或非标字体(错误4001)。2023年统计显示,30%的提交因模块1格式错误被退回,凸显**信息合规的重要性。验证工具如LORENZ eValidator被FDA官方采用,可自动检测200+项技术指标。中国香港eCTD服务商美国IND注册申报相关技术支持。

eCTD验证标准的严格性与分类:欧盟对eCTD的验证要求分为“错误”“警告”和“提示信息”三级,其中“错误”项直接导致申报被拒。验证项目涵盖六大类共149条,包括文件命名规范(如路径长度限制)、PDF可读性(禁止密码保护)、XML骨架文件完整性等。例如,文件扩展名必须符合规范(如.xpt用于临床数据集),而文件夹层级需避免空目录或混合存放文件。相较于中国《电子申报验证标准》的简化版(54条),欧盟的验证体系更为复杂,体现了其高标准的技术监管。
欧洲药品管理局:集中审评程序由欧洲药品管理局(European Medicines Agency, EMA)负责协调。 人用药品委员会:人用药品委员会(Committee for Medicinal Products for Human Use, CHMP)负责提供科学意见。 欧盟委员会:CHMP的意见随后被提交给欧盟委员会(European Commission, EC),由欧盟委员会做出是否授权的终决定。这个决定在整个欧盟都是具有法律约束力的。 审批过程: 申请人向EMA提交申请,包括eCTD(电子通用技术文档)格式的药品注册文档。 EMA的CHMP分配一个科学评估团队(Rapporteur和Co-Rapporteur),负责初步评估。 CHMP基于评估团队的报告提供科学意见。 欧盟委员会根据CHMP的意见做出终决定,批准或拒绝药品上市。 授权范围 如果药品获得批准,将获得在整个欧盟、冰岛、列支敦士登和挪威有效的上市许可(Central Marketing Authorisation, CMA)。澳大利亚DMF注册申报相关技术支持。
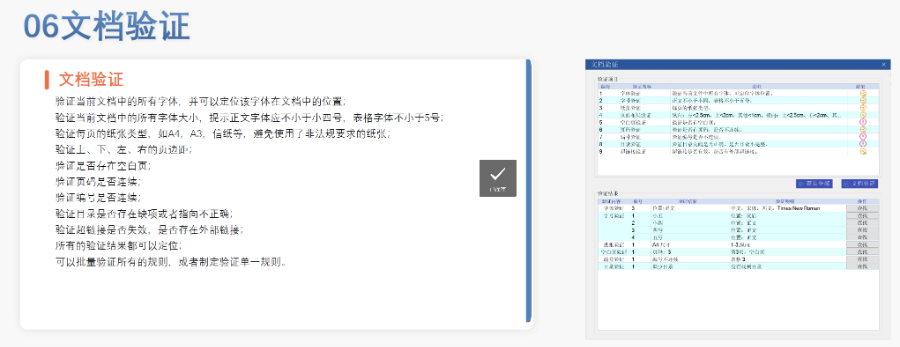
2020年暴发后,FDA进一步推动电子化进程,例如允许远程电子签章和临时放宽部分格式要求,但验证标准(如PDF版本、书签链接有效性)并未降低。这一时期的实践为eCTD在紧急审批中的灵活性提供了案例,也凸显了其作为危机应对工具的价值。 尽管美国尚未部署eCTD V4.0,但其技术方向已明确:支持**器械和保健品申报、增强数据可复用性、优化审评系统与人工智能的集成。此外,区块链技术在电子签章和数据溯源中的应用探索,可能成为下一阶段升级的重点加拿大ANDA注册申报相关技术支持。山东国际注册eCTD服务电话
加拿大eCTD注册咨询相关技术支持。中国澳门国产eCTD
FDA围绕eCTD发布了10余项法规指南,涵盖格式要求、文件生命周期、数据**等细节,其中《ICH M2 EWG》作为综合性技术文件,成为广发·体育申报的参考。eCTD的实施提升了审评效率,通过标准化XML结构和电子签章技术,减少了纸质递交的物流与时间成本,同时支持全生命周期管理,便于后续变更和补充资料的动态更。 美国在eCTD实施中注重与ICH国际标准的兼容性,例如采用统一的CTD模块化结构和PDF技术规范。然而,其区域性要求(如信封信息中的Application ID、Submission Subtype)仍体现本土化特色。这种“国际框架+本地适配”的模式,既保障了跨国药企的申报便利,又满足了FDA的监管需求。中国澳门国产eCTD
赋悦科技(杭州)有限责任公司是一家有着雄厚实力背景、信誉可靠、励精图治、展望未来、有梦想有目标,有组织有体系的公司,坚持于带领员工在未来的道路上大放光明,携手共画蓝图,在浙江省等地区的数码、电脑行业中积累了大批忠诚的客户粉丝源,也收获了良好的用户**,为公司的发展奠定的良好的行业基础,也希望未来公司能成为行业的翘楚,努力为行业领域的发展奉献出自己的一份力量,我们相信精益求精的工作态度和不断的完善创新理念以及自强不息,斗志昂扬的的广发·体育精神将引领赋悦科技供应和您一起携手步入辉煌,共创佳绩,一直以来,公司贯彻执行科学管理、创新发展、诚实守信的方针,员工精诚努力,协同奋取,以品质、服务来赢得市场,我们一直在路上!